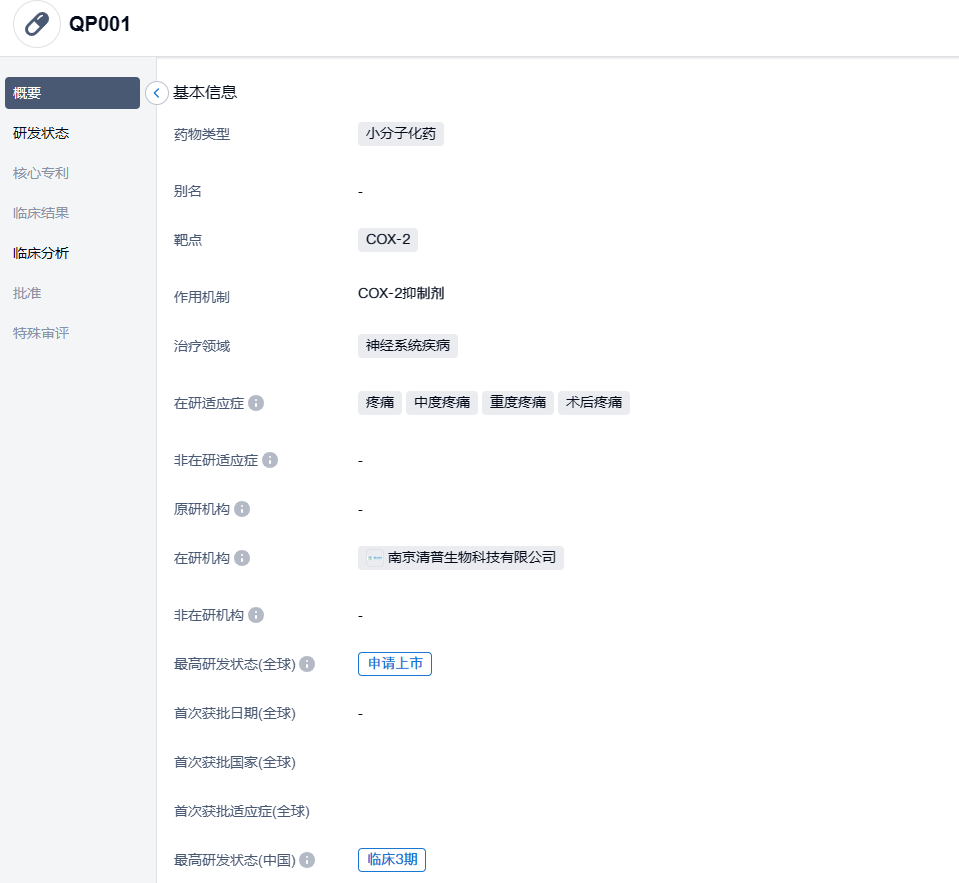
2023年的9月7日,南京清普生物获得了来自国家药品监督管理局药品审评中心(CDE)的QP001注射液新药营销许可申请(NDA)的正式受理通知。在两个月之前,这家公司也已经从FDA获得了QP001药品项目NDA的批准,其NDA编号为217593,PDUFA日期定于2024年2月26日。QP001可能会成为首个在中国和美国同时获得批准销售的新型镇痛药品。
QP001注射液是南京清普生物科非阿片类止痛药品管线的首款产品,也在中国和美国同时申请许可,并可用于治疗各种急性疼痛问题,特别是适用于治疗围术期疼痛。与现有的相同种类药物相比,不论在镇痛效果、安全性以及镇痛持续时间都有显著优势。QP001项目是基于清普自主知识产权的难溶药物增溶技术平台(SimSolTM)开发的。清普生物已经成功地与FDA召开了关于QP001项目的pre-NDA会议,并已经收到FDA关于QP001项目“Application Fee Waivers”(注册费用减免)的确认函。根据《联邦食品、药品和化妆品法案》(FD&C Act)第736(d)(1)(C)章节,南京清普生物有资格享受QP001项目NDA申请费用的减免,此优惠也让它成为国内罕有的拥有FDA“Application Fee Waivers”证书的生物医药公司。
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
QP001注射液在中国的上市申请主要基于两项确证性3期临床试验结果。这些试验有50多个临床研究中心参与,用时小于9个月完成所有参试者入组。两项3期临床试验的结果都非常积极,主要和次要的终点都达到了统计学的差异,证实了QP001注射液能在24小时内保持强力镇痛效果,并且其镇痛效果和安全性都优于相同类型的药物。
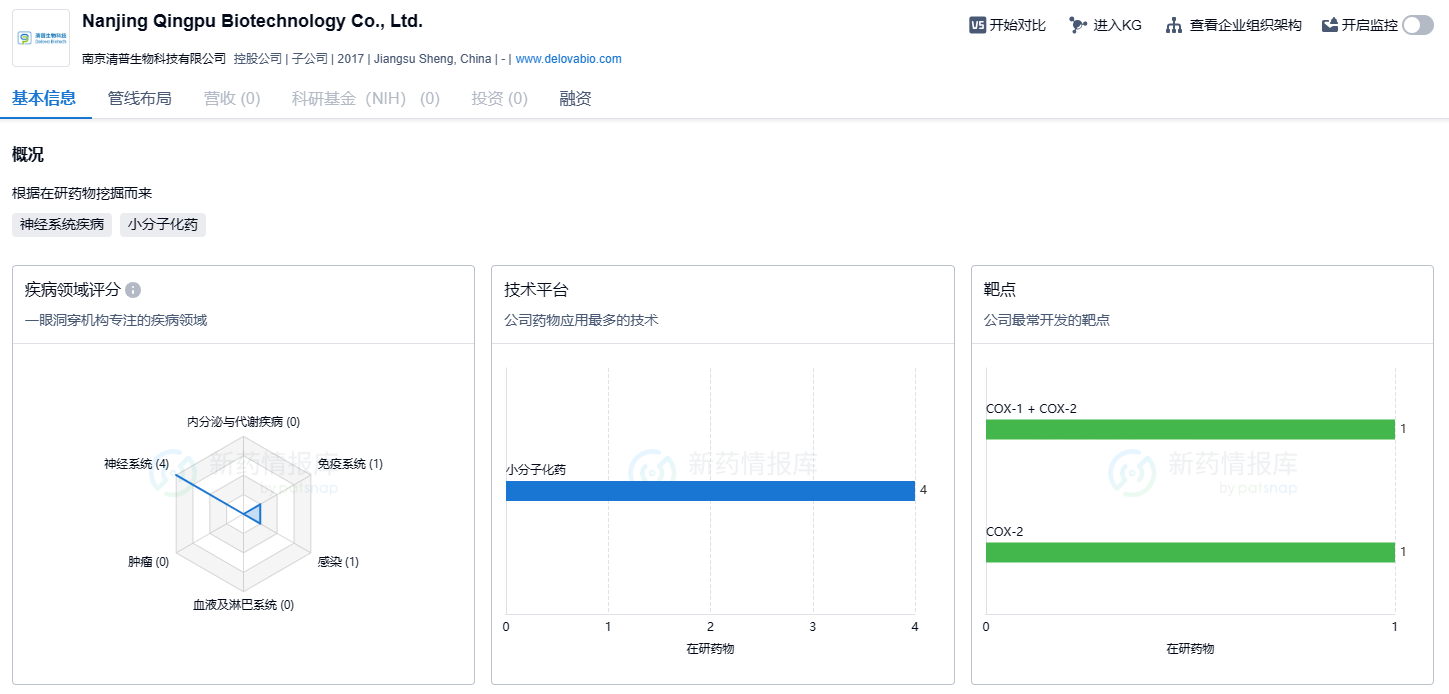
根据智慧芽新药情报库所披露的信息,南京清普生物科技有限公司在小分子新药的研发中投入极大,研发重心位于神经系统领域,期盼公司的核心产品QP001早日在国内外上市。