南京维立志博生物科技有限公司在2023年7月31日公告,自家研发并具备全球独立知识产权的新型1类药物——GPRC5D/CD3双特异性抗体LBL-034,已获得中国国家药品监督管理局(NMPA)与美国食品药品监督管理局(FDA)批准进行首次临床试验,以治疗复发或难以治疗的多发性骨髓瘤(R/RMM)。
该公司自主开发的 LBL-034是种双特异性抗体,旨在同时对GPRC5D和CD3执行靶向攻击,它连接了CD3+ T细胞和表达GPRC5D的肿瘤细胞,诱导T细胞攻击骨髓瘤细胞。即将对R/RMM病患进行的临床试验,有望使LBL-034成为针对GPRC5D靶点治疗多发性骨髓瘤的首选药物。
 (文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
这场刚获批准的单臂,多中心,公开标签,剂量递增且扩展的首次临床研究,预计将纳入接受过至少一种蛋白酶体抑制剂(PI),一种免疫调节剂(IMiD)等标准治疗未能成功治疗的R/RMM病患。研究的目标在于验证LBL-034在R/RMM患者中的安全性和耐受性,确定其II期临床试验的推荐剂量,并评估其治疗效果。
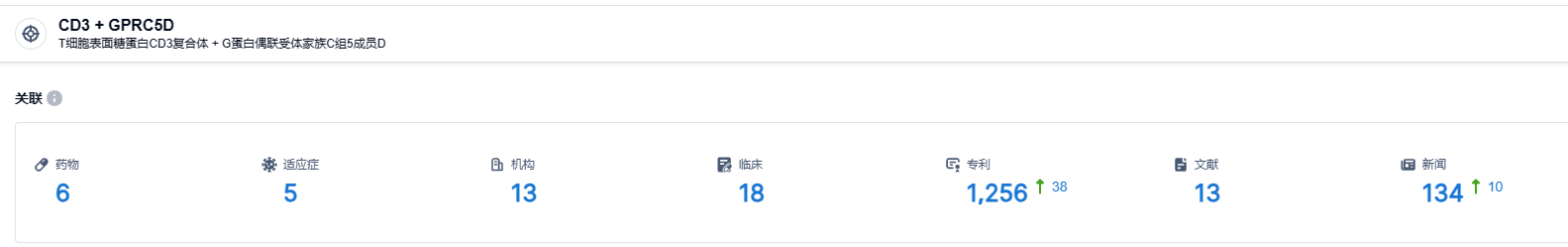 根据智慧芽新药情报库发布的信息显示,截至2023年8月1日,目标研发CD3和GPRC5D的药品共有6个进行研究,有5种可能的适应病症,共有13个研发机构,相关的临床试验有18个,专利达到1256份。期待LBL-034在后续临床试验中能获得顺利进展.
根据智慧芽新药情报库发布的信息显示,截至2023年8月1日,目标研发CD3和GPRC5D的药品共有6个进行研究,有5种可能的适应病症,共有13个研发机构,相关的临床试验有18个,专利达到1256份。期待LBL-034在后续临床试验中能获得顺利进展.






