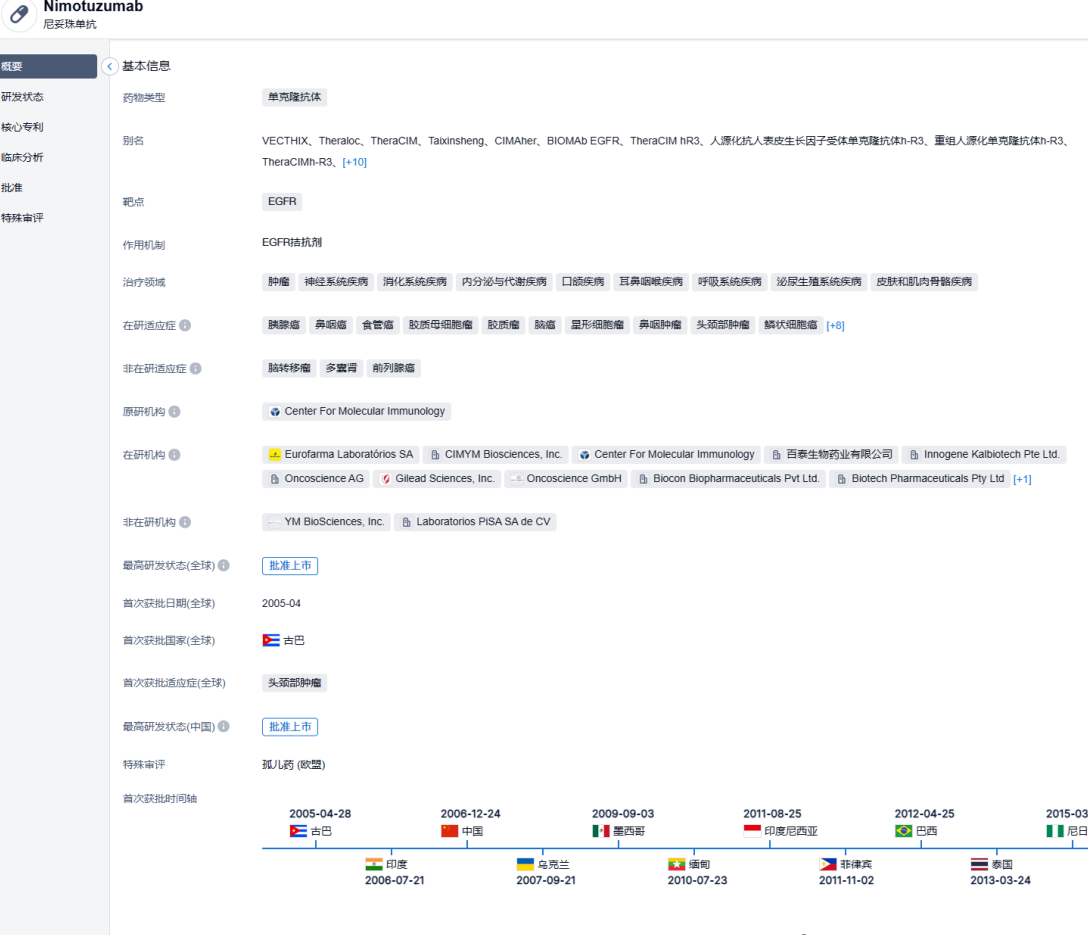
2023年6月12日,国家药监局批准尼妥珠单抗联合吉西他滨用于治疗胰腺癌患者。这是该产品获批的第2项适应症。此前,尼妥珠单抗已于2008年在中国获批用于与放疗联合治疗表皮生长因子受体 (EGFR) 表达阳性的III/IV期鼻咽癌患者。
尼妥珠单抗是由中古合资企业百泰生物药业公司研发生产的国内第一个人源化单克隆抗体,2008年获得国家药监局批准在中国上市,批准治疗鼻咽癌。 近年来,正在进一步开展尼妥珠单抗治疗头颈部肿瘤、胰腺癌、食管癌、宫颈癌和神经胶质瘤等多个癌种的临床研究。
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
本次尼妥珠单抗获批的胰腺癌新适应证主要基于Notable研究结果。这是一项在中国开展的前瞻性、随机对照、双盲、多中心Ⅲ期临床试验,共纳入了92例KRAS野生型局部晚期或复发转移性胰腺癌患者,随机分为试验组(尼妥珠单抗+吉西他滨,n=46)与对照组(安慰剂+吉西他滨,n=46),并根据病灶位置及治疗史等因素进行分层。结果表明,在全分析集(FAS)中,试验组中位总生存(mOS)较对照组显著延长(10.9个月 vs 8.5个月,HR=0.50,p=0.024),死亡风险显著降低50%。试验组的中位无进展生存期(mPFS)为4.2个月(vs. 3.6个月),疾病进展或死亡风险显著降低44%。
胰腺癌被称为恶性肿瘤的“癌中之王”,患者5年生存率仅5%-9%。目前手术切除依然是胰腺癌治愈的最主要的手段之一,但单纯依靠外科手术,患者获益相对有限。在就诊的胰腺癌患者中,有60%已经发生转移,其中位生存期(mOS)只有6个月;25%的患者为局部晚期,mOS只有9个月;初诊适合手术切除患者仅15-20%,但这类患者的mOS也仅有20个月左右。因此,胰腺癌诊治面临巨大的挑战。
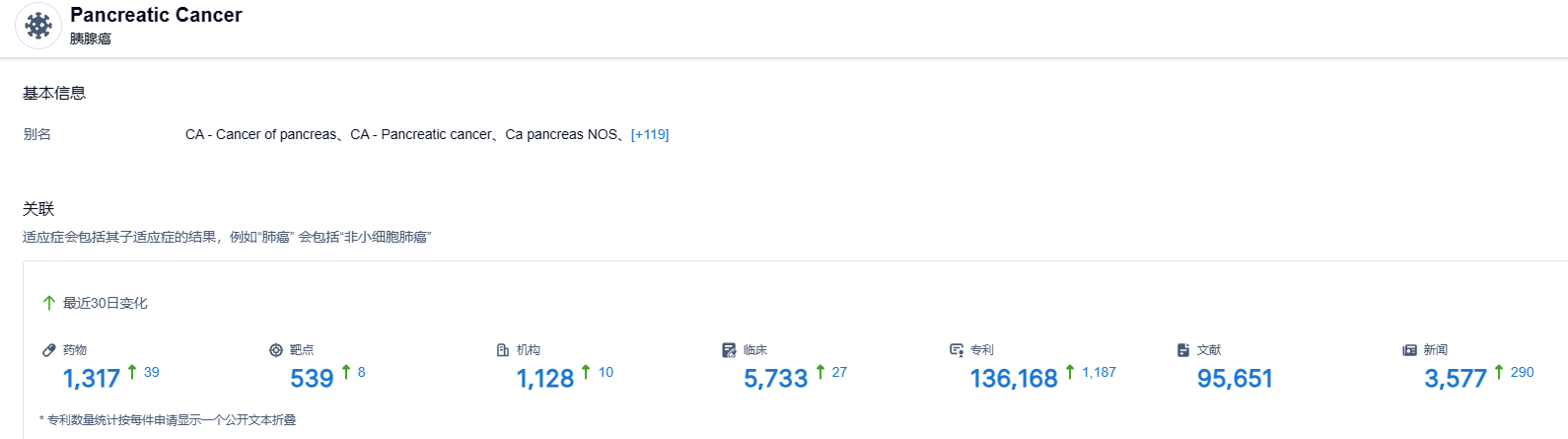
根据智慧芽新药情报库所披露的信息 ,截止2023年6月13日,胰腺癌适应症共有在研药物1317个,包含的靶点有539种,在研机构1128家,涉及相关的临床试验5733件,专利多达136168件。。。胰腺癌诊治难度大,期待尼妥珠单抗能够给国内胰腺癌患者带来新的治疗选择。