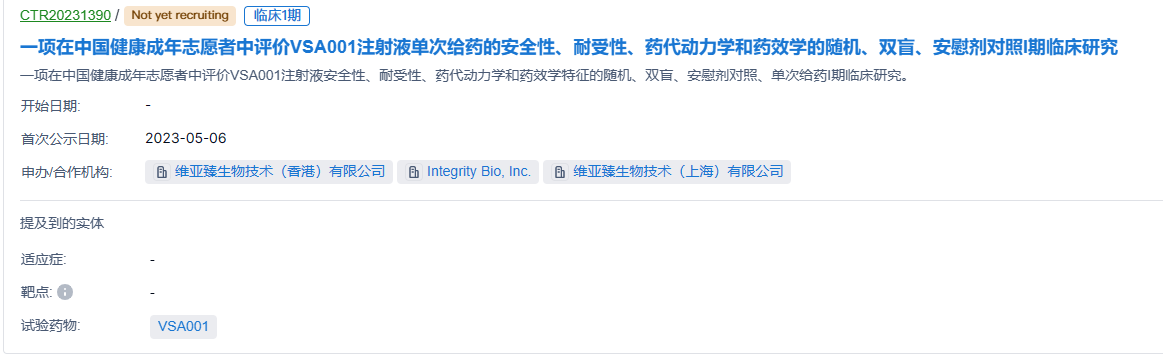
2023年5月31日,维亚臻生物技术(上海)有限公司(以下简称“维亚臻”)宣布,其在研1类新药VSA001注射液在北京大学第三医院顺利完成首例受试者给药。本试验是一项随机、双盲、安慰剂对照的I期临床试验(CTR20231390),旨在评估VSA001在中国成年健康志愿者中的安全性、耐受性以及药代动力学和药效动力学特征。
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
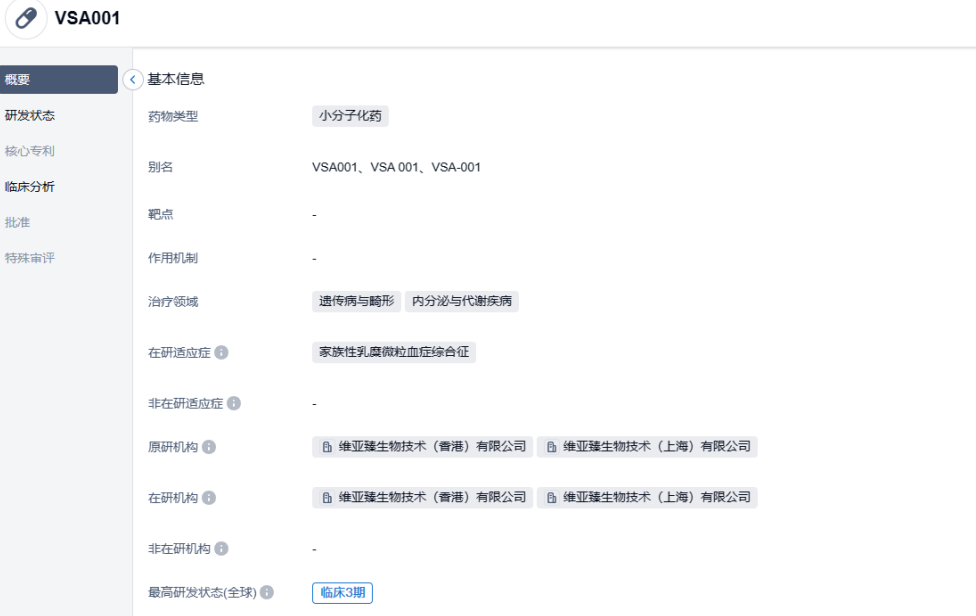
VSA001是一款治疗脂质代谢紊乱的肝脏靶向小干扰RNA(siRNA)药物,通过有效且持久地沉默载脂蛋白C3的信使RNA(APOC3 mRNA)来降低APOC3蛋白水平表达,基于脂蛋白脂酶(LPL)依赖途径和非依赖途径,达到显著降低血清甘油三酯(TG)和富含甘油三酯脂蛋白(TRL)及其降解残留物水平的作用。
VSA001作为维亚臻重要的临床产品管线之一,境外完成的I期及正在进行中的II期临床试验数据已展现出显著的临床疗效、良好的安全性及较长的给药间隔等临床优势;此外,境外全球多中心FCS(家族性乳糜微粒血症综合征) III期临床试验已完成全部患者的入组。
家族性乳糜微粒血症综合征(FCS)是一种严重的极罕见遗传疾病,据不完全统计其患病率约为1/1,000,000,通常由多种单基因(例如LPL、GPIHBP1、APOC2、APOA5或LMF1)功能缺失突变引起。FCS通常导致空腹TG水平极度升高(900 mg/dL以上),严重TG升高可导致多种临床症状及严重并发症,包括可致命的急性胰腺炎、反复腹痛、2型糖尿病、肝脂肪变性和认知功能问题(也称为“脑雾”)。
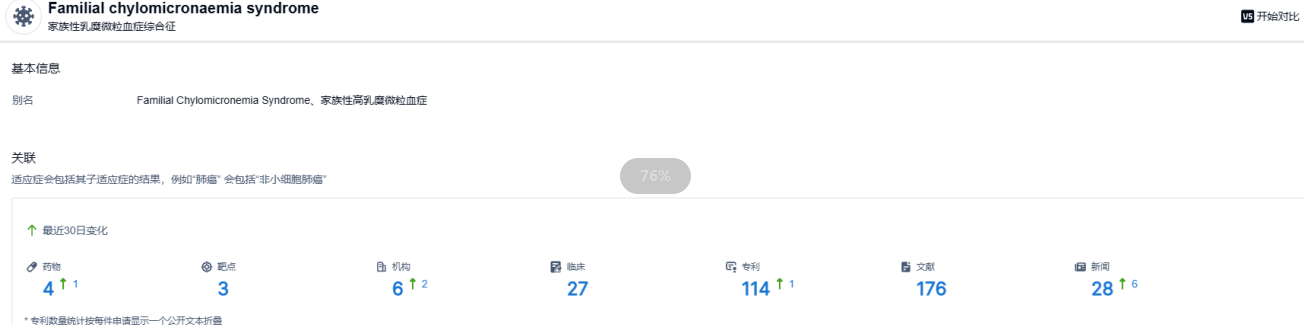
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 家族性乳糜微粒血症综合征 适应症注册登录后可免费获得该适应症下的在研药物、靶点、研发机构、临床试验等详细信息),特应性皮炎 适应症共有在研药物4个,包含的靶点有3种,在研机构6家,涉及相关的临床试验27件,专利114件。。。目前有效治疗FCS的药物选择非常有限,期待VSA001能够成功获批,给患者带来新的治疗选择。