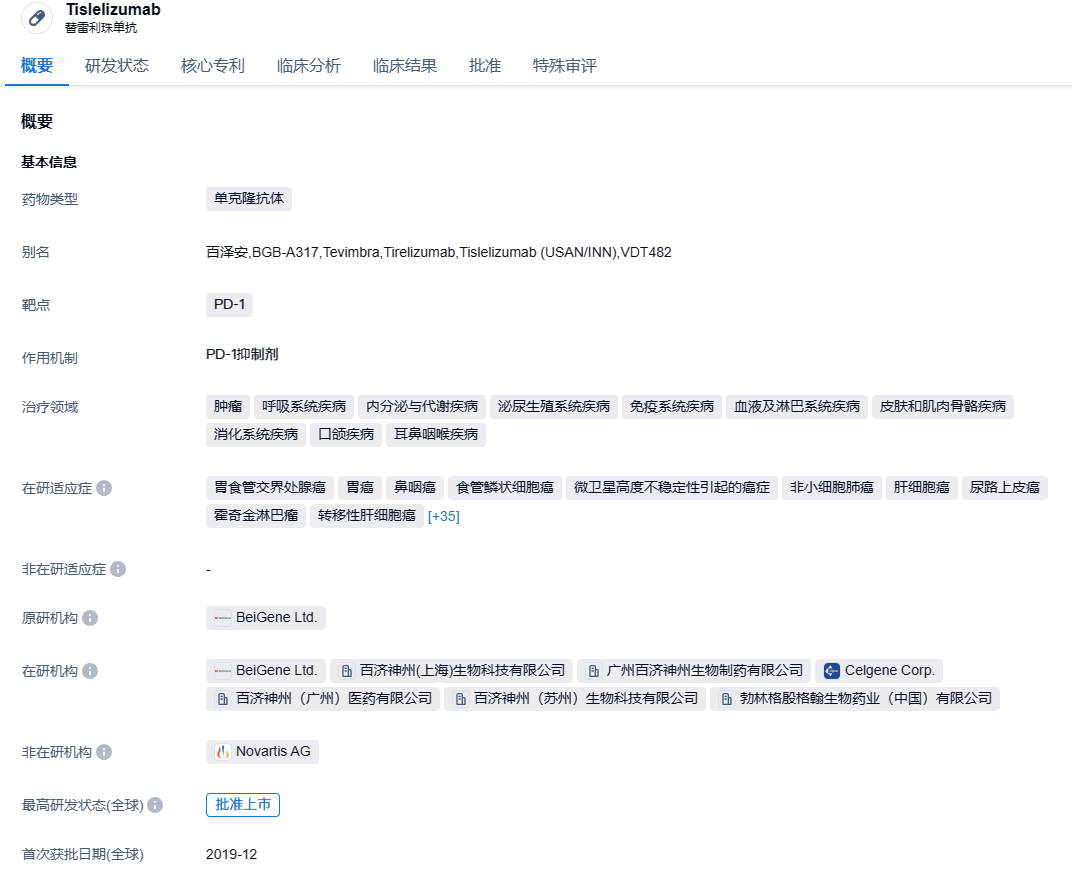
2024年1月2日,药监局官网显示,百济神州的替雷利珠单抗注射液(商品名:百泽安)获批用于治疗一线不可切除或转移性肝细胞癌(HCC)患者。
百泽安®(替雷利珠单抗注射液)是一款人源化IgG4抗程序性死亡受体1(PD-1)单克隆抗体,设计目的旨在最大限度地减少与巨噬细胞中的Fcγ受体结合。临床前数据表明,巨噬细胞中的Fcγ受体结合之后会激活抗体依赖细胞介导杀伤T细胞,从而降低了PD-1抗体的抗肿瘤活性。百泽安®是第一款由百济神州的免疫肿瘤生物平台研发的药物,目前正进行单药及联合疗法临床试验,以开发一系列针对实体瘤和血液肿瘤的广泛适应症。2021年1月,百济神州曾与诺华就PD-1抗体替雷利珠单抗达成首付款6.5亿美元,总价超22亿美元的合作,百济神州瑞士授予诺华在美国、加拿大、墨西哥、欧盟成员国、英国、挪威、瑞士、冰岛、列支敦士登、俄罗斯和日本开发、生产和商业化替雷利珠单抗的权利。根据授权协议,诺华负责在授权国家的注册申请,并有权在获批后开展商业化活动。2023年9月19日晚间,百济神州宣布其自主研发抗PD-1抗体替雷利珠单抗(百泽安®)获得欧盟批准,作为单药用于治疗既往接受过含铂化疗的不可切除、局部晚期或转移性食管鳞状细胞癌(ESCC)的成人患者。
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
本次上市申请基于一项随机、开放性的全球III期RATIONALE 301研究(NCT03412773)的积极数据。RATIONALE 301研究旨在评估替雷利珠单抗对比索拉非尼一线治疗不可切除HCC成人患者的疗效与安全性,主要终点是两个治疗组总生存期(OS)的非劣效性比较。关键次要终点是盲态独立审查委员会(BIRC)根据RECIST 1.1版评估的总缓解率(ORR)。其它次要终点包括有效性评估(如根据BIRC评估的无进展生存期、缓解持续时间和至疾病进展时间)和健康相关生活质量指标,以及安全性与耐受性。结果显示,替雷利珠单抗与索拉非尼相比展示出在OS上的非劣效性结果。替雷利珠单抗治疗组的中位OS为15.9个月,而索拉非尼治疗组的OS为14.1个月(HR:0.85 [95.003% CI: 0.712,1.019]),试验未达到优效结果。次要终点方面,与索拉非尼相比,替雷利珠单抗治疗组具有更高的客观缓解率(ORR:14.3% vs 5.4%)和更持久的缓解(中位缓解持续时间DoR:36.1个月 vs 11.0个月)。替雷利珠单抗治疗组与索拉非尼治疗组的中位无进展生存期(PFS)分别为2.1个月和3.4个月。
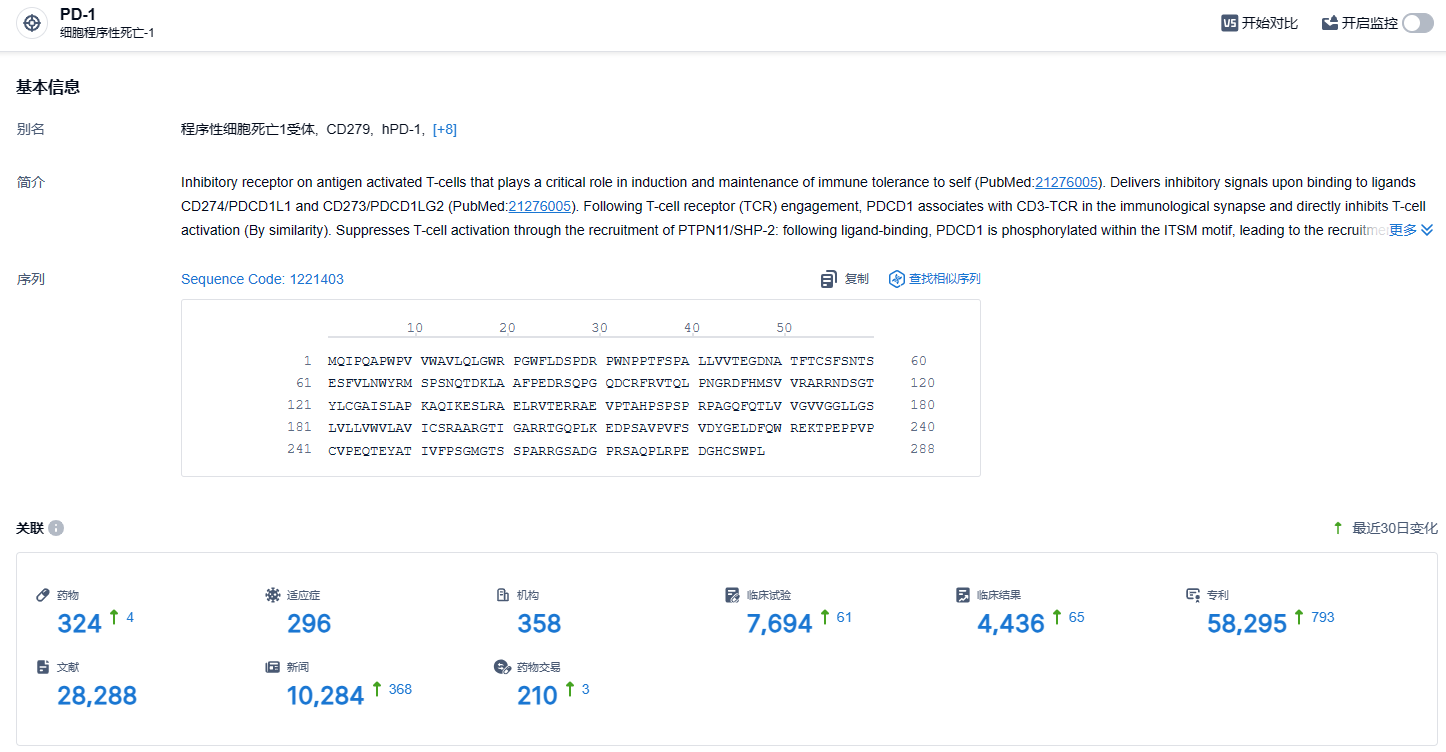
根据智慧芽新药情报库所披露的信息,截止到 2024 年1月3日,PD-1 靶点共有在研药物324个,包含的适应症有296种,在研机构358家,涉及相关的临床试验7694件,专利多达58295件……PD-1/PD-L1靶点是研发非常火热的领域,国内目前已经有10余款相关新药上市,替雷利珠单抗2022年在国内销售额高达18.36亿元。在这一红海市场,商业化与更进一步的临床推进成了药企pk的重中之重。作为首款出海成功的国产PD-1单抗,替雷利珠单抗的商业化设计和临床设计非常值得国内PD-1/PD-L1新药企业的学习。期待有更多国产新药登陆欧美发达国家的医药市场。