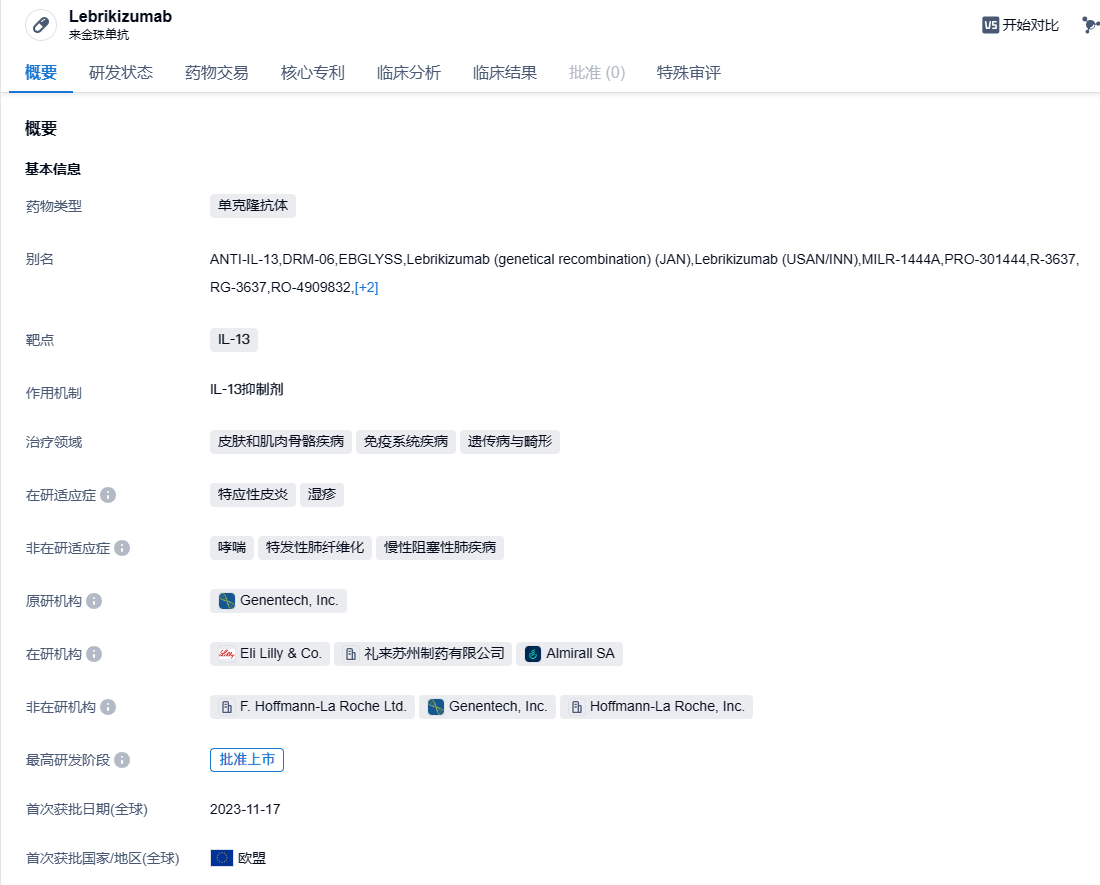
近日,中国国家药监局药品审评中心(CDE)官网公示,礼来公司(Eli Lilly and Company)申报的lebrikizumab注射液获得临床试验默示许可,拟开发用于治疗中重度特应性皮炎(AD)青少年(12岁及以上,体重至少为40kg)和成人患者。公开资料显示,这是Almirall公司和礼来联合开发的IL-13特异性抗体疗法,已经于今年11月在欧盟获得全球首批,用于青少年和成人中度至重度特应性皮炎患者。
Lebrikizumab是一种新型的抗IL-13单克隆抗体,具有生物利用度高和半衰期长的特点,能够高亲和力结合可溶性IL-13,阻断IL-13介导的信号通路。此前,Lebrikizumab曾获得FDA的快速通道资格。Lebrikizumab最初由Tanox开发,名称为TNX-650;2007年Genentech(罗氏子公司)收购Tanox,Lebrikizumab成为了罗氏管线中的一员。 紧接着,2017年Dermira支付罗氏8000万美元首付款、14亿美元里程碑总额,获得Lebrikizumab全球权益。2019年6月,该药的欧洲权益又被出售给Almirall。2020年1月,礼来以总价11亿美元收购了Dermira,Lebrikizumab欧洲以外的全球权益落入礼来手中。
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
Lebrikizumab的批准基于三项关键性3期临床试验:ADvocate 1和ADvocate 2评估其作为单药治疗的效果,ADhere评估其与外用皮质类固醇(TCS)联用的效果。在第16周,lebrikizumab作为单药治疗展示了早期临床疗效,超过50%的患者实现了疾病程度和严重性至少下降75%(EASI-75)。与TCS联用时,这一有效性提高到了近70%的患者。值得注意的是,长期扩展试验结果显示,在第16周获得缓解并继续接受lebrikizumab治疗的患者,无论是接受单药治疗还是与TCS联用,几乎80%的患者可在长达两年的时间内持续保持皮肤清洁、止痒和疾病严重程度减轻。这些研究中的安全性评估显示,大多数不良事件(AE)严重程度为轻微或中等,并未导致治疗中断。最常见的不良反应包括结膜炎、注射部位反应、和干眼症。
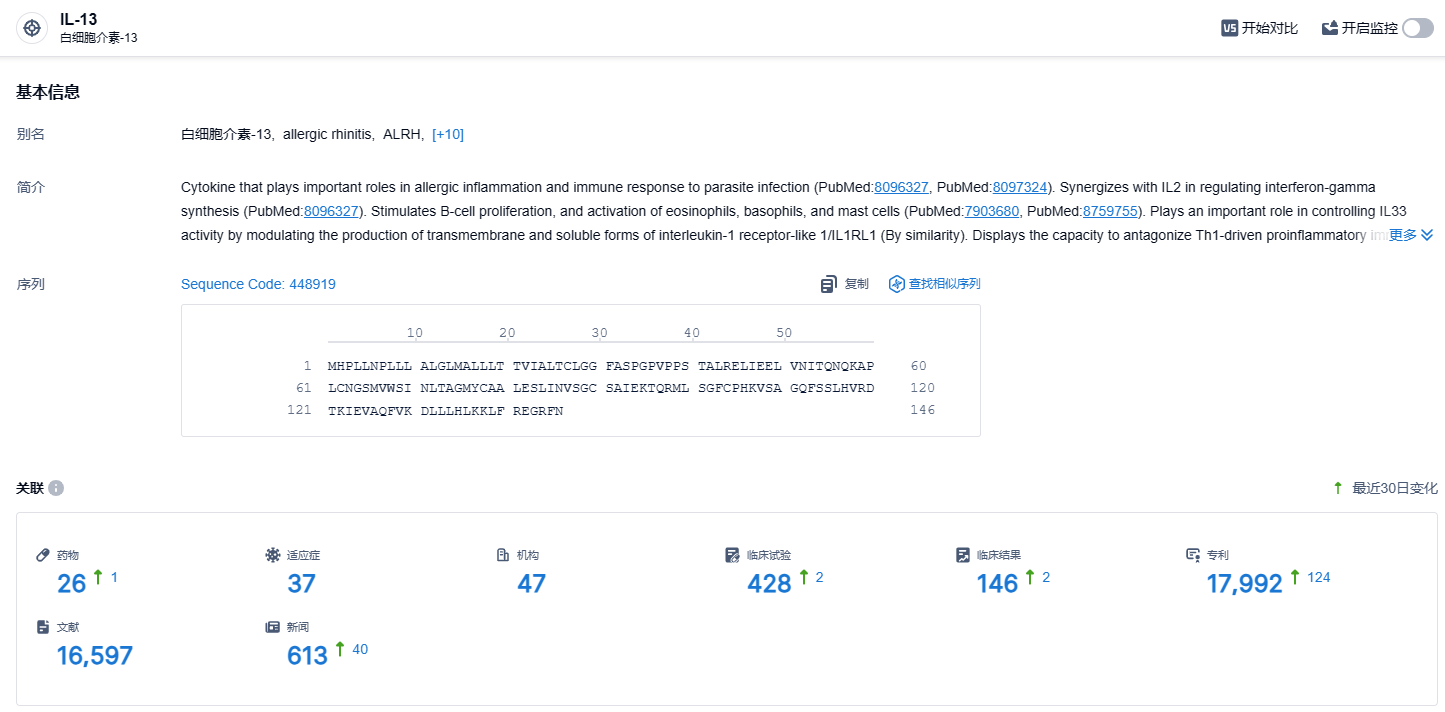
根据智慧芽新药情报库所披露的信息 (点击下方图片直达IL-13靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年12月19日,IL-13 靶点共有在研药物26个,包含的适应症有37种,在研机构47家,涉及相关的临床试验428件,专利多达17992件……今年10月2日,FDA宣布拒绝批准礼来用于治疗中度至重度特应性皮炎(湿疹)的Lebrikizumab生物许可申请(BLA),主要原因是在检查中发现了第三方合同生产组织(CMO)的问题。 来自FDA的CRL中没有提到对Lebrikizumab的临床数据、安全性或标签的担忧,因此,如果CMO问题可以有效解决,或者生产转移到新的合作伙伴,等待批准时间或许不用太久。本次Lebrikizumab在国内获批临床,期待Lebrikizumab能够研发顺利。