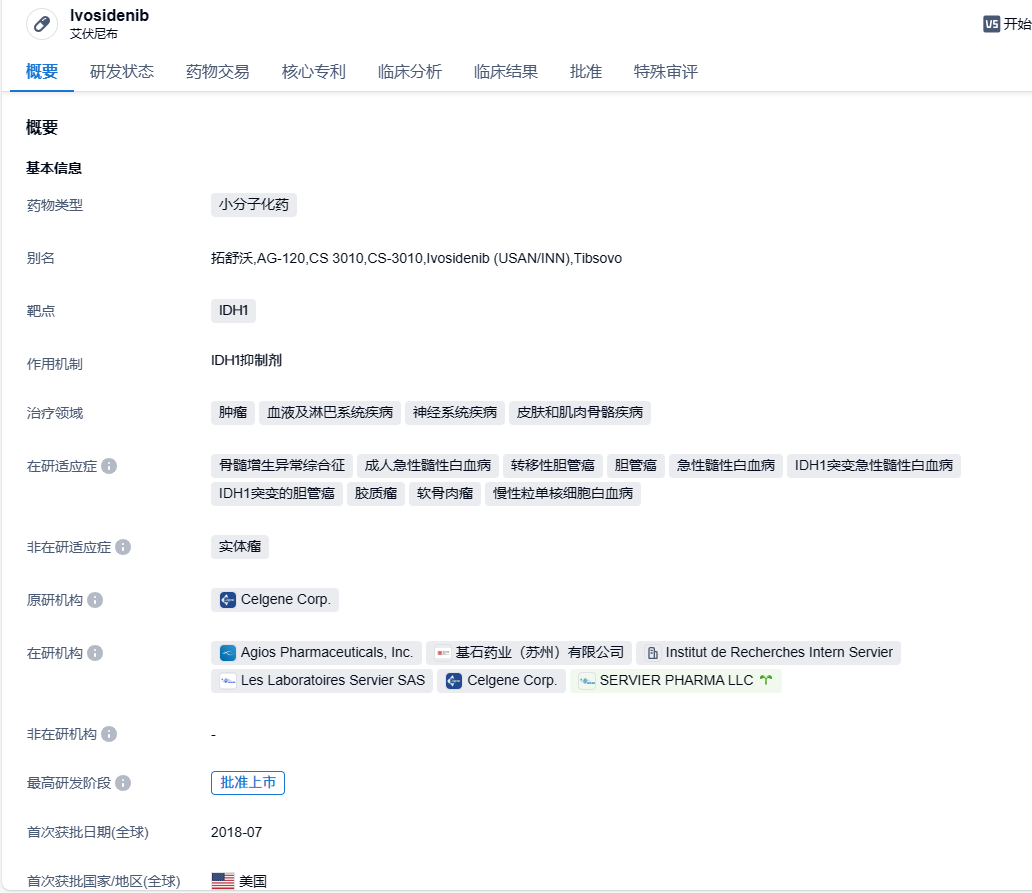
2023年11月14日,基石药业的合作公司施维雅公告,拓舒沃(艾伏尼布片)已经获得美国FDA的许可,用以治疗IDH1突变的复发或难治性(R/R)骨髓增生异常综合征(MDS)。据悉,这成为艾伏尼布片在IDH1突变肿瘤领域的第五个适应症。
此药物艾伏尼布(商品名拓舒沃)最初由Agios Pharmaceuticals公司研发,是国内首个获得批准的针对异柠檬酸脱氢酶-1(IDH1)突变癌症的强效口服靶向抑制剂。在2018年,基石药业与Agios达成了在大中华区进行开发及商业化的独家合作关系,并在2020年将合作范围扩展到新加坡。2020年12月,施维雅以20亿美元的价格收购了Agios药业公司的肿瘤业务线,其中包括艾伏尼布(ivosidenib)。施维雅和基石药业根据授权许可协议继续就艾伏尼布在包括中国大陆、香港、台湾及澳门地区在内的大中华地区以及新加坡地区进行临床开发与商业化开展独家合作。
在美国,此药已获得FDA的批准,用于治疗经FDA批准的试验检测出的携带易感IDH1突变的患者,包括新诊断下的急性髓系白血病(AML),复发或难治性AML,复发或难治性MDS,以及局部晚期或转移性胆管癌。在中国,艾伏尼布也已经获得了批准,用于治疗携带易感IDH1突变的成年复发性或难治性AML患者。同时,艾伏尼布也已经获取了FDA授予突破性疗法认定,用于治疗携带IDH1突变的成年R/R MDS患者,并被授予优先审评资格。
 (文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
FDA此次新适应症批准基于艾伏尼布片在IDH1突变的复发性或难治性MDS患者(n=18)中进行的关键1期开放标签的临床研究结果。研究数据表明,接受艾伏尼布治疗的患者其完全缓解率(CR)达到38.9%,客观缓解率(ORR)为83.3%。而且,患者能够达到CR的中位时间为1.9个月。
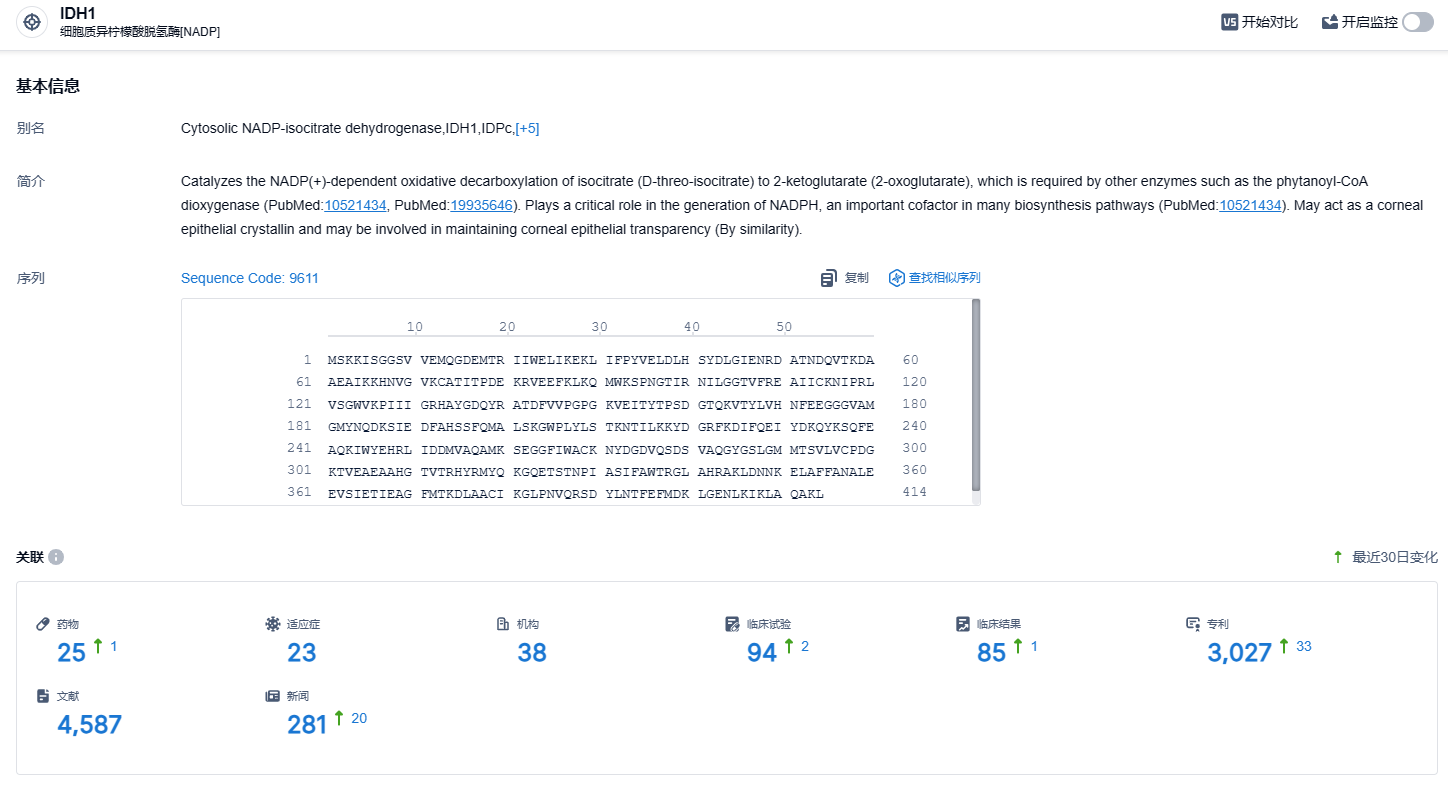
根据智慧芽新药情报库所披露的信息,截止到 2023 年11月15日,共有25种靶向IDH1的在研药物,涵盖23种适应症,研究机构达38家,涉及的临床试验94项,专利数量高达3027个。在美国,每年约有16000人被诊断为MDS,大约3.6%的MDS患者携带IDH1突变,这种突变被视为一种早期的"驱动"突变。对于患有IDH1突变的MDS患者而言,其预后常常与较差的整体治愈效果以及更高的进展成为急性髓系白血病(AML)的风险相关。艾伏尼布新适应症的审批,为急性髓系白血病患者提供了新的治疗方案。