2023年9月13日,中国国家药监局药品审评中心(CDE)公告,强生(Johnson & Johnson)公司提交的特立妥单抗注射液上市申请将被列入优先审批范围内,此药物预期的适应病症用于治疗曾经接受过至少三种疗法(含一种蛋白酶体抑制剂、一种免疫调节药物和一种抗CD38单克隆抗体)的复发性或难以治疗的多发性骨髓瘤的成年人患者。
特立妥单抗(别名:Teclistamab/JNJ-64007957/JNJ-7957)是通过利用Genmab的DuoBody双特异性抗体平台创建的1+1非对称双特异性体,其瞄准的靶点为BCMA/CD3,抗体骨架采用IgG4并对PAA进行突变,以消除IgG4的天然交换特性和与Fc的相关功能(如ADCC,CDC)。2022年8月25日,欧洲联盟委员会(EC)给予了BCMA/CD3双特异性抗体Tecvayli(也就是特立妥单抗)有条件上市的许可,该药品适用于单药治疗多次复发/难以治疗的多发性骨髓瘤(RRMM)成年患者。紧接着在2022年10月25日,特立妥单抗在美国获得了FDA的上市批准,商品名为Tecvayli。作为一种双抗剂皮下注射剂,特立妥单抗在依从性上具有优势。值得关注的是,这是强生公司在多发性骨髓瘤治疗领域投放的第四款新药,有望为强生在全球多发性骨髓瘤治疗市场的定位带来新的改变。
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
FDA对特立妥单抗的审批基于该药物的 I/II 期临床试验 MajesTEC-1 研究(试验登记号:NCT04557098,NCT03145181)。这项研究是一个单臂、开放标签、多队列、多中心剂量递增研究,以 ORR 作为主要终点。在此关键 II 期试验中,研究纳入的患者(n=110)中,已经接受过五线治疗的患者占了其中的78%,而总缓解率(ORR)达到了 61.8%(95% CI:52.1%,70.9%),其中 28.2% 的患者得到完全缓解(CR)或严格完全缓解(sCR)。首次响应中位时间为1.2个月(范围:0.2 - 5.5个月)。中位随访7.4个月,6个月的预估的持续缓解(DOR)率为90.6%(95% CI:80.3%,95.7%),9个月的DOR率则为66.5%(95% CI:38.8%,83.9%)。
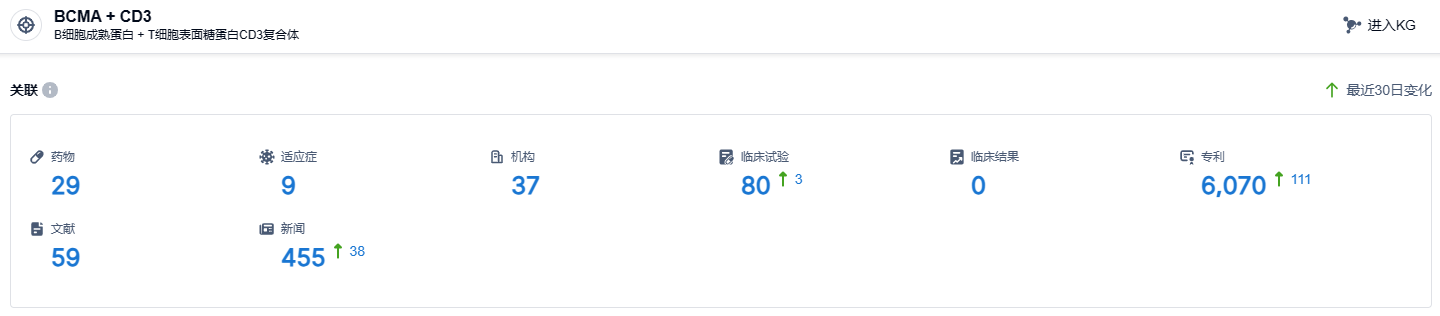
根据智慧芽新药情报库所披露的信息,截止到2023年9月15日,BCMA/CD3靶点共有29个药物正在研发阶段,包含9种适应症,研究机构有37家,临床试验数量达80次,专利申请尽多达到6070个。目前,有多款BCMA/CD3靶向新药正在积极开发中,如强生的特立妥单抗,和辉瑞公司的Elranatamab已得到了上市的许可;再生元公司的linvoseltamab已成功进入到临床三期;康诺亚生物的CM336、岸迈生物的EMB-06,以及TeneoBio/艾伯维的TNB-383B都已经成功进入到临床 I/II期阶段。特立妥单抗,作为首款获得批准的BCMA/CD3双抗,期盼能尽早在国内经过审批并投放市场,为国内患者带来新的治疗选择。