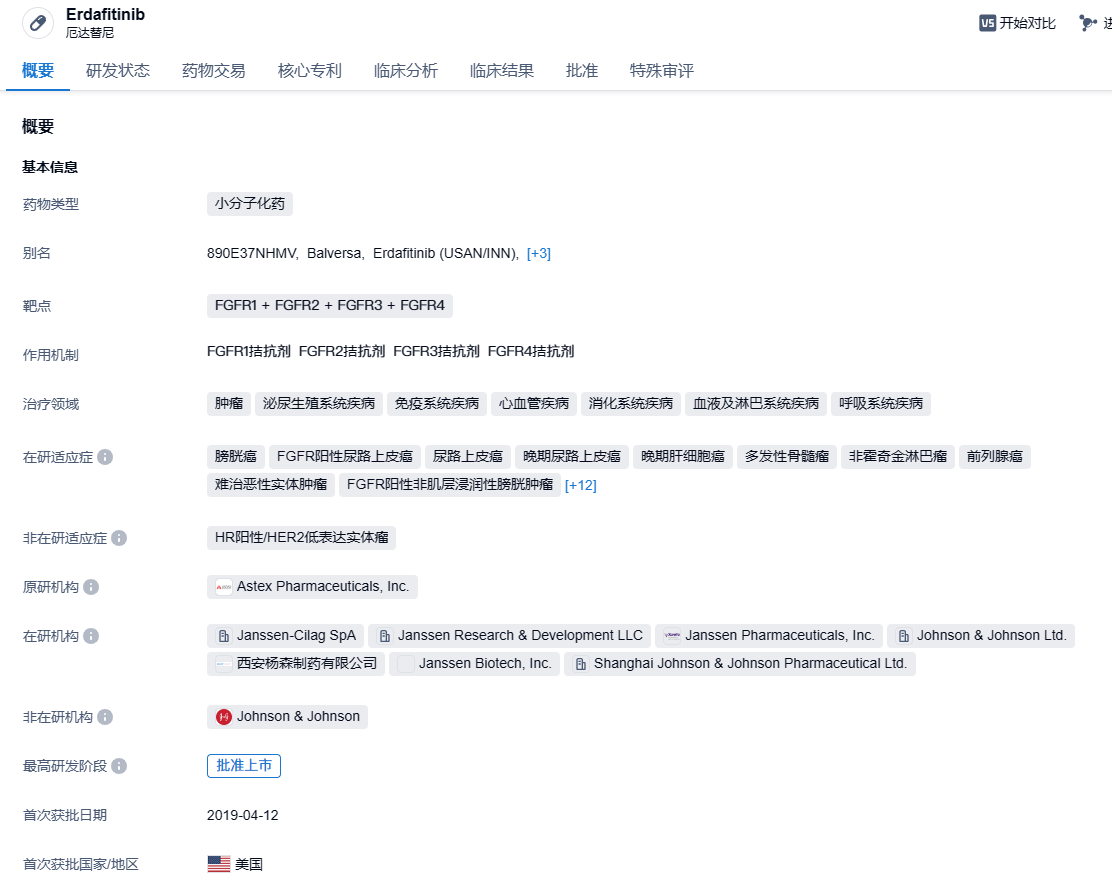
近日,强生(Johnson & Johnson)公司宣布其小分子抑制剂Balversa(erdafitinib)获美国FDA完全批准,用于治疗局部晚期或转移性尿路上皮癌(mUC)成人患者,这些患者带有FGFR3遗传变异并经过至少一线系统性治疗后疾病发生进展。
Balversa (erdafitinib,厄达替尼) 是强生开发的一款口服泛FGFR酪氨酸激酶抑制剂,具有抗肿瘤活性,该药是首款被FDA批准的口服FGFR抑制剂。2019年4月,FDA加速批准厄达替尼用于治疗携带有FGFR3或FGFR2突变的铂类化疗后疾病进展的局部晚期或转移性膀胱癌成人患者,包括新辅助或辅助铂化疗12个月内的患者。FGFRs是一类典型的受体酪氨酸激酶(receptor tyrosine kinases,RTKs),其家族包括FGFR1、FGFR2、FGFR3和FGFR4四种受体。研究表明FGFR的高表达、突变等导致其信号通路异常激活,异常激活使肿瘤细胞以"自给自足"的方式维持生长,促进细胞增殖、上皮间质转化和血管生成以及肿瘤细胞的侵袭、转移和对治疗的耐受,与乳腺癌、肺癌、尿路上皮癌、子宫内膜癌、卵巢癌等多种疾病的发生发展密切相关。2023年12月15日,CDE官网显示,强生厄达替尼(erdafitinib,商品名:Balversa)片上市申请获受理,用于治疗晚期尿路上皮癌。
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
这一批准决定是基于临床3期试验(THOR)的积极结果。该试验是一个随机、开放标签、多中心的研究,入组的mUC患者带有特定的FGFR遗传变异,且在接受一线或二线治疗期间或之后发生疾病进展。THOR试验结果显示,用于二线治疗时,对比化疗,在之前接受过PD-1或者PD-L1抑制剂治疗的患者中,Balversa改善患者的总生存期,并降低其死亡风险达36%。接受Balversa治疗患者的中位生存期比接受化疗的患者长4个月(HR:0.64;95%CI:0.47–0.88;P=0.0050)。Balversa相关的常见不良反应包括磷酸盐升高、指甲疾病、口腔炎、腹泻等。
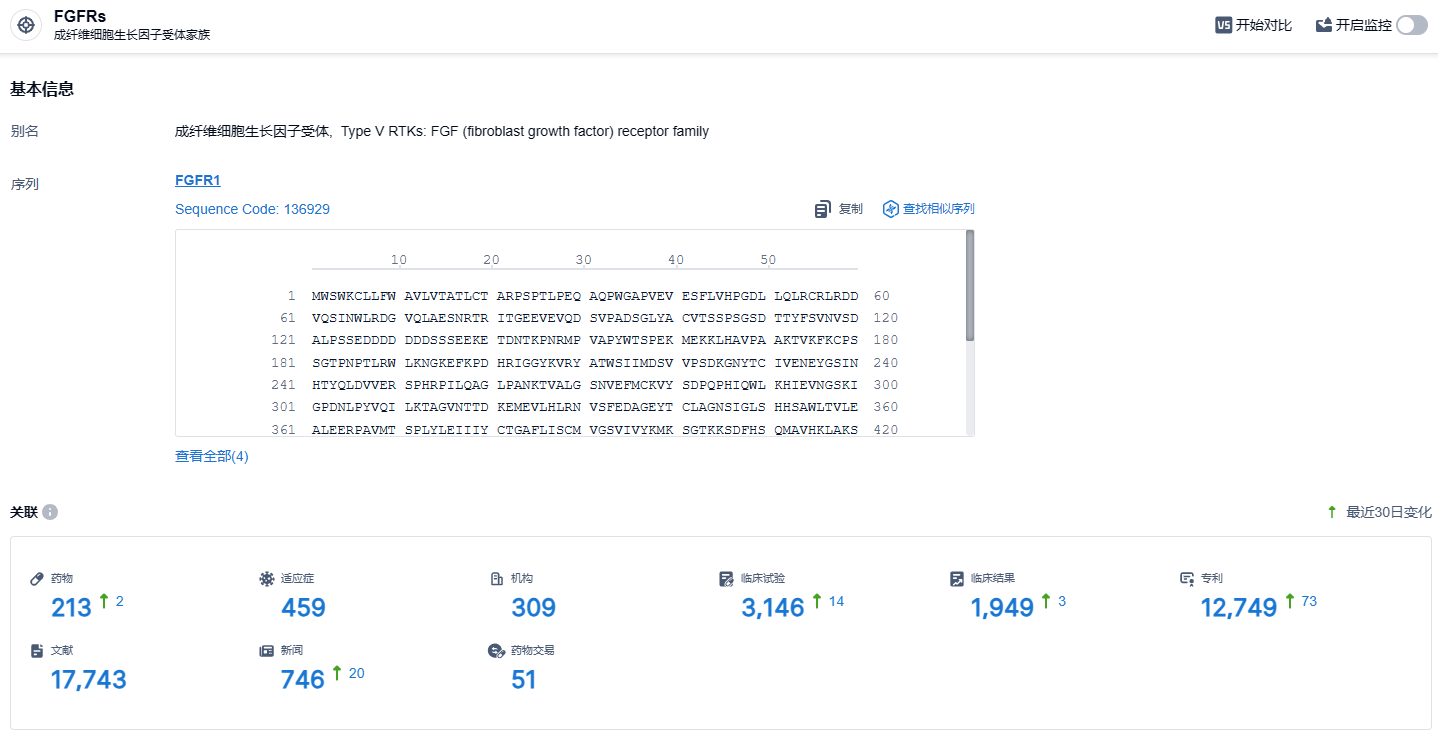
根据智慧芽新药情报库所披露的信息,截止到 2024 年1月23日,FGFRs靶点共有在研药物213个,包含的适应症有459种,在研机构309家,涉及相关的临床试验3146件,临床试验结果1949件,专利多达12749件……erdafitinib在具有FGFR基因突变的晚期实体瘤患者中具有良好的疗效,能使大批患者受益,能够为已经没有治疗选择的患者群体提供一种有效的治疗手段。这些结果将支持Erdafitinib在晚期实体瘤患者中的继续研究和开发。