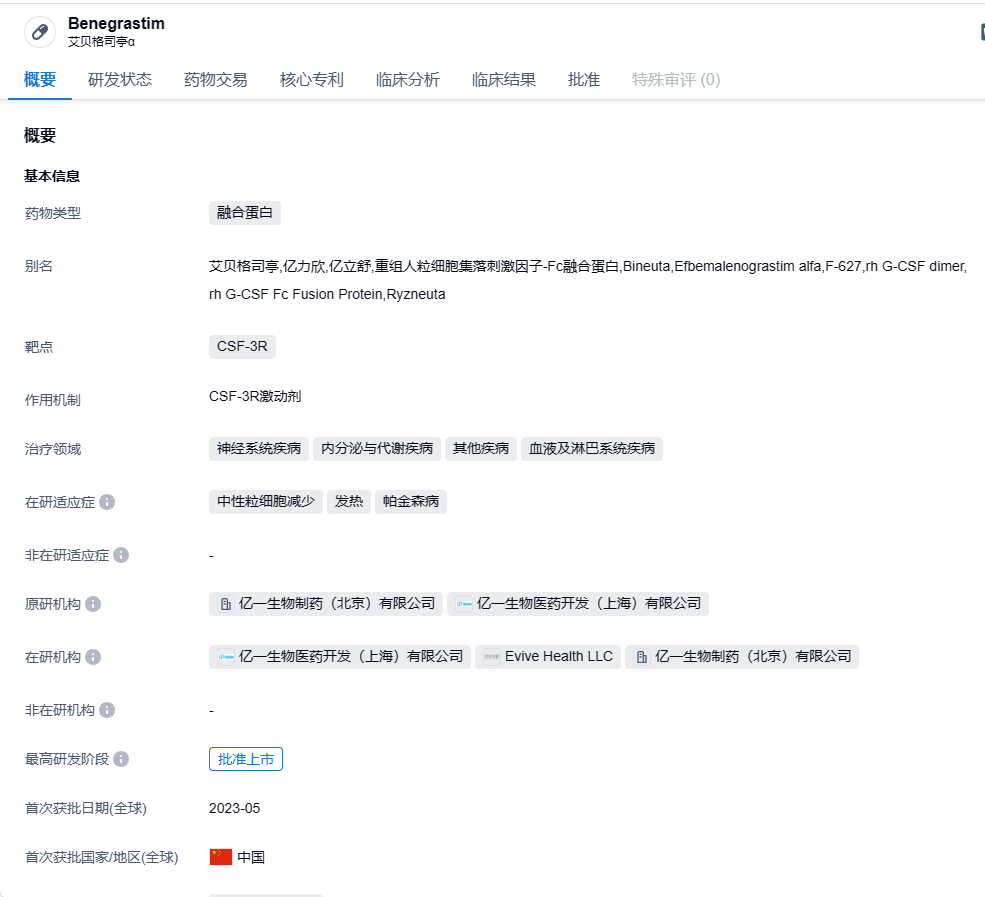
2023年11月17日,亿帆医药公布了一份公告,公告中表明其控股子公司亿一生物(Evive Biotech)研发的艾贝格司亭α注射液(研发代码:F-627)已经获得了美国FDA许可,用于治疗成年非髓性恶性肿瘤病患在接受容易引起发热性中性粒细胞减少症的骨髓抑制性抗癌药物治疗时,能够有效减缓以发热性中性粒细胞减少症为表现的感染发生率。
艾贝格司亭α是基于亿一生物拥有自主知识产权Di-KineTM双分子技术平台研发的原创生物药品。它是基于Fc融合蛋白技术进行研发的,由CHO细胞表达的rhG-CSF二聚体构成。艾贝格司亭α是第三代长效升白药物,并且是全球第一款双分子G-CSF-Fc融合蛋白,主要靶向CSF-3R,拥有高度稳定性以及低免疫原性的显著优势。2023年5月,该药品已经成功获得NMPA的批准并且上市。在此之前,亿一生物已经和正大天晴药业南京顺欣制药进行了合作,根据合作条款,亿一生物将F-627在中国的商业化利益独家授权给正大天晴南京顺欣,并且将获得高达2.1亿人民币的首付款与里程碑付款,以及分级的净销售额提成费。
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
2018年1月,亿一生物成功完成了艾贝格司亭α注射液在美国和欧洲进行的首个3期临床试验(简称“04试验”),实验结果显示,该药物疗效达到预设主要疗效终点,安全性和耐受性均符合预期。2020年1月,亿一生物收到了在我国进行艾贝格司亭α注射液3期临床试验《统计数据图表合集》,从统计结果来看,该药品在我国的3期临床试验疗效已经全面达到预期的临床试验评价标准,疗效与对照药品(原研药品重组人粒细胞集落刺激因子)相当。
2020年6月,亿一生物又取得了在美国和欧洲开展的第二个国际三期临床试验(简称“05试验”)《统计数据图表合集》,结果表明该试验成功达成预设的主要和次要疗效终点,药物疗效与对照药物相当。2020年7月,公司完成了05试验有关免疫原性中和抗体检测,结果为阴性,说明无药物相关的抗体产生;至此,艾贝格司亭α注射液在国内外的1-3期临床试验均已顺利完成并达到预设的临床目标。2021年3月,亿一生物就艾贝格司亭α注射液向FDA提交了生物制品许可申请。
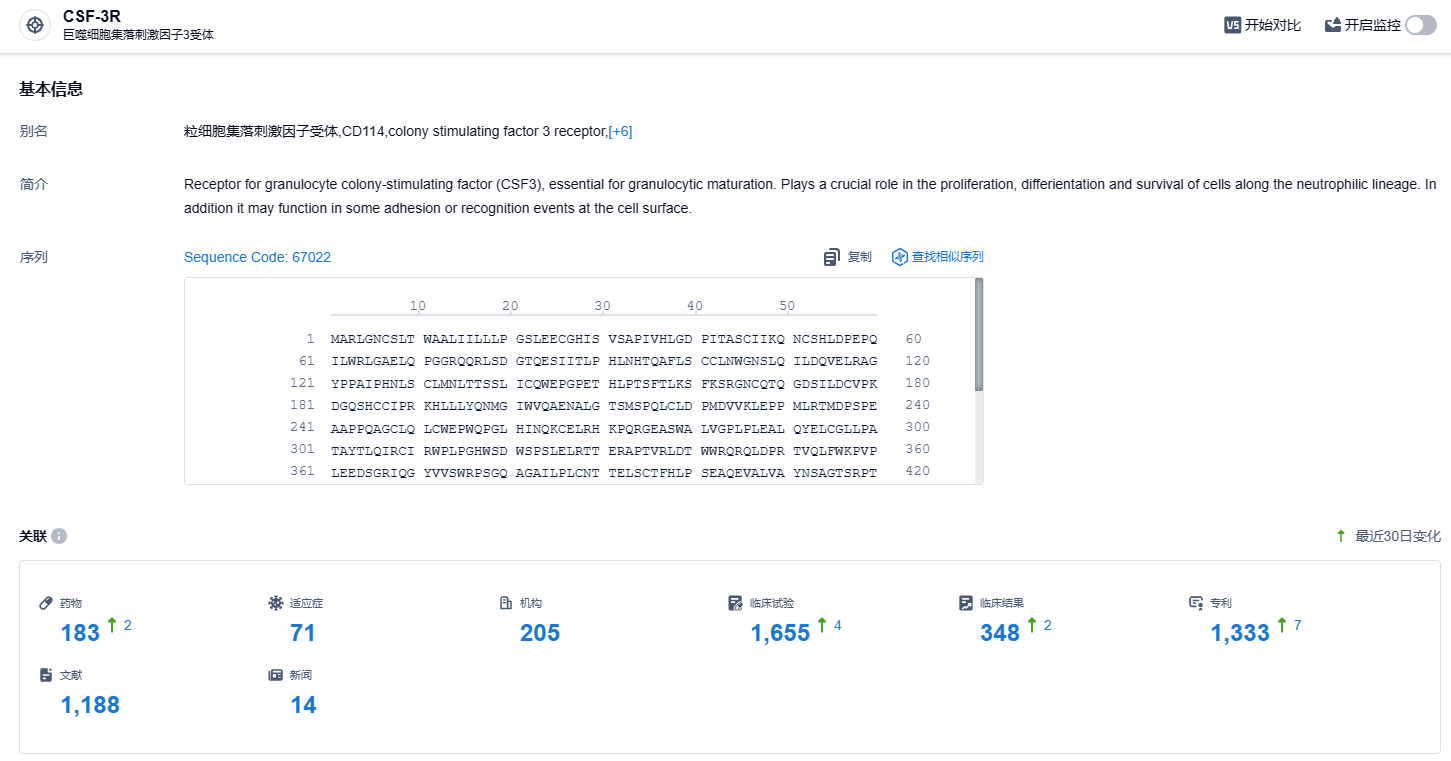
根据智慧芽新药情报库所披露的信息 ,截止到 2023 年11月18日,总共有183款药物在开展CSF-3R靶向研究,包括了71种疾病适应症,205个研究机构参与,临床试验达到了1655项,专利则高达1333项...CSF分为长效和短效两种类型,其中短效G-CSF需要在每一轮化疗中每天给药1~2次,如安进的Nupogen(非格司亭)、中外株式会社的Lenograstim(来格司亭)。长效G-CSF则主要通过聚乙二醇修饰来制备,在一个化疗周期中,通常只需注射一次,比如安进的Neulasta(培非格司亭,糖基化修饰)、恒瑞医药的艾多(硫培非格司亭)。我们期待艾贝格司亭α能够在美国商业化顺利,展示我国在创新药品方面的实力。